- 1 Installation av pumpar
- 2 Skötsel och Underhåll av pumpar
- 3 Pumpar, funktion och konstruktion
- 3.1 Allmänt om Pumptyper
- 3.2 Rotordynamiska pumpars grunder
- 3.3 Förträngningspumpars grunder
- 3.4 Pumpkurvor
- 3.5 Pumpars sugförmåga, NPSH och kavitation
- 3.6 Centrifugalpumpars utföranden
- 3.6.1 Vattenpumpar
- 3.6.2 VVS pumpar
- 3.6.3 Vattenautomater
- 3.6.4 Länspumpar
- 3.6.5 Flerstegspumpar
- 3.6.6 Djupbrunnspumpar
- 3.6.8 Spolpumpar
- 3.6.9 Standardpumpar enligt ISO
- 3.6.10 Kemipumpar och processpumpar
- 3.6.11 Tätningslösa pumpar
- 3.6.12 Pumpar av plast
- 3.6.13 Massapumpar
- 3.6.14 Godspumpar
- 3.6.15 Livsmedelspumpar
- 3.6.16 Stockningsfria pumpar
- 3.6.17 Dubbelsidigt sugande pumpar
- 3.6.18 Propellerpumpar
- 3.7 Vätskeringpumpar
- 3.8 Förträngningspumpars utförande
- 3.9 Övriga pumpar
- 3.11 Pumpval
- 4 Material och materialval
- 4.1 Inledning
- 4.2 Materialöversikt för pumpar
- 4.3 Materialhållfasthet och trycktäthet för pumpar
- 4.4 Korrosion och Erosion på pumpar
- 4.5 Materialval pumpar för slitande vätskor
- 4.6 Kavitationsbeständiga material i pumpar
- 4.7 Materialkombinationer och materialval i pumpar
- 4.8 Praktiska problemställningar vid materialval för pumpar
- 5 Pumptätningar
- 6 Axelkopplingar för pumpar
- 6.2 Val av axelkoppling
- 6.3 Typ av koppling för pumpar
- 6.4 Uppriktningsfel för pumpar
- 6.5 Axelkopplingar, krafter och moment
- 6.6 Pumpkopplingar och dess driftsfaktorer
- 6.7 Pumpkopplingars varvtal, dimensioner och vikt
- 6.10 Pumpkopplingar, uppställning och demontering
- 6.11 Pumpkopplingars livslängd och kostnader
- 6.12 Pumpaxlars uppriktning
- 7 Drivutrustning för pumpar
- 8 Flödesreglering för pumpar
- 8.2 Anpassning av pumphjulets diameter
- 8.3 Seriekoppling och parallellkoppling av pumpar
- 8.4 Polomkopplingsbar asynkronmotor
- 8.5 Start och stoppreglering av pumpar
- 8.6 Driftsföljder vid start- stoppreglering
- 8.7 Magasinsvolymer vid start-stopp reglering
- 8.8 Kontinuerlig reglering av pumpar
- 8.9 Strypreglering av pumpar
- 8.10 Shuntreglering av pumpar
- 8.11 Varvtalsreglering av pumpar
- 8.12 Ekonomiska aspekter vid varvtalsreglering av pumpar
- 8.13 Val av utrustning för varvtalsreglering av pumpar
- 9 Storheter och enheter för pumpar
- 10 Vätskors egenskaper
- 11 Vätskeströmning
-
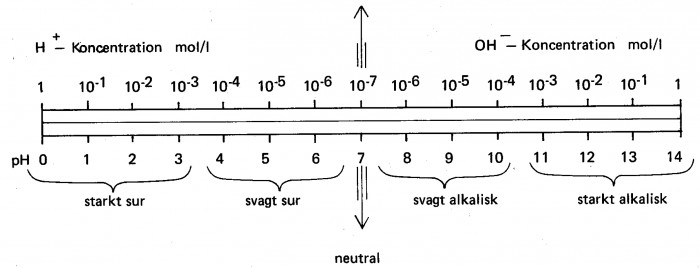
pH-värde
För att på ett bekvämt sätt uttrycka vätejonkoncentrationen i vätskor har en symbolisk beteckning pH (pH värde) införts. Storheten pH kallas även surhetsgraden. Faktorn pH är den faktor som bestämmer klassificeringen av kemiska substanser under tre huvudgrupper:
- Syror – substanser som reagerar med metall genom att frigöra väte.
- Baser – substanser som kan kombineras med syror, varvid en tredje grupp bildar ett salt och vatten.
- Salter
pH täcker en skala från 0-14. Sura vätskor har pH 0-6,5, neutrala har pH 6,5-7,5 och alkaliska har pH 7,5-14.
Vatten är i rent tillstånd en mycket dålig elektrisk ledare. Sin ledningsförmåga får vatten först i lösningar med s k elektrolyter som salter, syror eller baser. Vid upplösning i vatten sönderfaller dessa ämnen i två beståndsdelar med motsatta elektriska laddningar varvid en elektrisk ström kan transporteras. Detta sönderfallsmoment kallas för elektrolytisk dissociation – spjälkning.
De laddade partiklar, som då uppstår, kallas joner. Man skiljer här mellan katjon-partiklar med positiv laddning och anjon-partiklar med negativ laddning. Beroende på laddningstillståndet betecknas de positivt laddade med + och de negativt laddade med -.
Metaller och väte i syror bildar vid den elektrolytiska dissociationen katjoner som alltid är positivt elektriskt laddade. Syraresterna och basernas hydroxylgrupper bildar däremot negativt laddade anjoner.
Alla lösningar, som reagerar surt, innehåller vätejoner H+ och alla lösningar, som reagerat alkaliskt, hydroxyljoner OH-. Sura reaktioner kan således betecknas som vätejonreaktioner och alkaliska reaktioner som hydroxyljonreaktioner.
-
Koncentrationen av vätejoner i en lösning är ett mått på lösningens surhet medan hydroxyljonkoncentrationen är ett mått på alkaliteten. Produkten av H+ och OH- joner är alltid konstant vid en bestämd temperatur. Jonprodukten K vid 22°C är t ex:
När båda jonslagen förekommer i samma antal i vatten så reagerar detta neutralt. Dvs då är:
Vid en given OH- – koncentration kan således värdet på H+ – koncentrationen beräknas.
För att undvika negativa 10-potenser används begreppet väteexponent eller pH-värde; definierat enligt
Genom att ange H+ – koncentration som 10-pH kan således vattnets surhetsgrad resp alkalitet fastställas. Värdet på pH varierar inom gränserna 0-14 se vidare figur 10.5.
För vätskor med pH-värden under 4 är vätejonkoncentrationen starkt bestämmande för hastigheten hos upplösningsförloppet för de flesta metaller. De positivt elektriskt laddade vätejonerna avger härvid sin laddning vid metallytan till metallatomerna och löser upp deras fasta bindningar medan de själva, som härigenom berövas sin jonkonstruktion, återvänder till atomtillståndet, förenar sig till molekyler och lämnar metallytan i form av gasbubblor. Av detta kan förstås att upplösningsprocessen förlöper häftigare ju högre vätejonkoncentrationen är dvs ju lägre pH-värdet hos vätskan är.
-
Inom pH-området ca 4-9 inverkar i vätskan befintligt syre t ex från luft på upplösningsförmågan för t ex järn. Det urladdade vätet avgår då inte i form av gasbubblor som fallet är inom pH-området 0-4, utan förenar sig i samma ögonblick det bildas med vattnets syre till vatten. Samtidigt omsätts det upplösta järnet till rost, till vilket även åtgår syre.
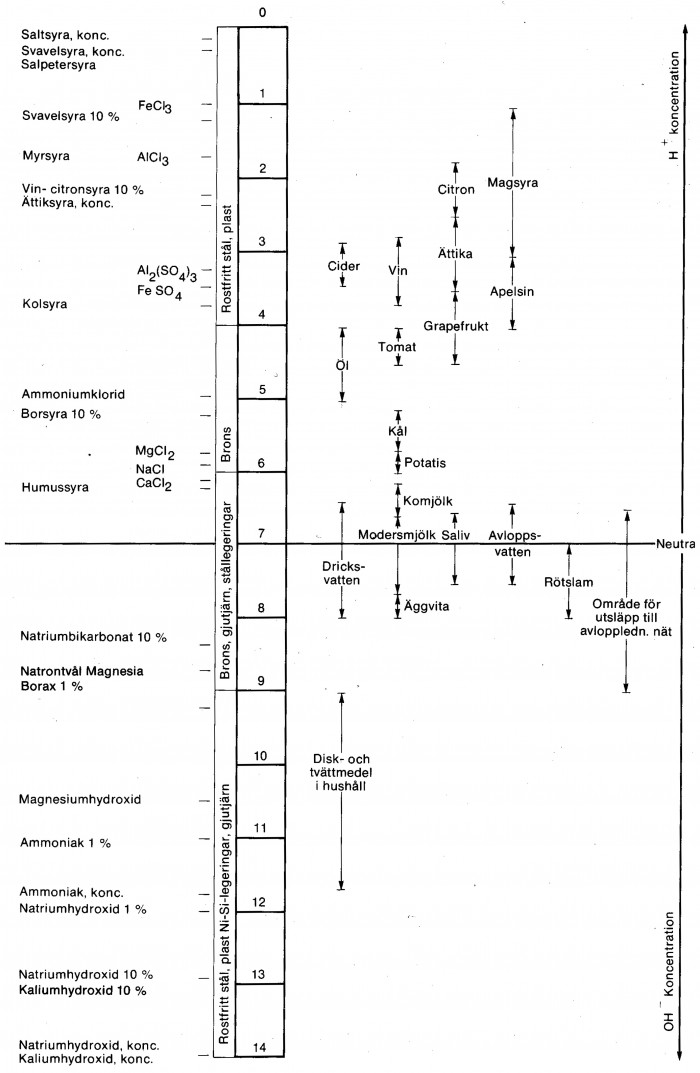
I figur 10.5 a Illustreras pH-områden för våra vanligaste födoämnen och drycker, samt hos kroppsvätskor, dricks- och avloppsvatten samt tvättmedel i förhållande till några vanliga kemiska vätskor. Dessutom anges lämpligt pumpmaterial för angivna pH-områden enligt vätsketabellerna.